깁스 자유 에너지
1. 개요
깁스 자유 에너지는 열역학적 함수로, 계의 엔탈피, 엔트로피, 절대 온도를 이용하여 정의된다. 깁스 자유 에너지는 화학 반응의 자발성을 예측하고, 평형 상태를 결정하는 데 사용된다. 깁스 자유 에너지의 변화량은 일정한 온도와 압력에서 반응의 자발성을 나타내며, 음수 값은 자발적인 반응을, 양수 값은 비자발적인 반응을 의미한다. 전기화학에서는 전지의 기전력과 관련되어 네른스트 식을 유도하는 데 사용되며, 표준 생성 깁스 자유 에너지는 물질의 안정성을 평가하는 데 활용된다.
| 정의 | 일정 온도와 압력 하에서 가역적 과정에 의해 얻을 수 있는 최대 비팽창 일의 양을 나타내는 열역학적 퍼텐셜 |
|---|---|
| 기호 | G |
| SI 단위 | 줄 (J) |
| 유도 단위 | 몰 에너지 (J/mol) |
| 공식 | ΔG = ΔH - TΔS (ΔG는 자유 에너지 변화, ΔH는 엔탈피 변화, T는 절대 온도, ΔS는 엔트로피 변화) |
| 기원 | 1870년대에 조사이어 윌러드 기브스가 개발 |
|---|---|
| 활용 | 화학 반응의 자발성 예측, 상평형 연구, 생물학적 에너지 변화 연구 등 |
| 성질 | 상태 함수, 크기 성질 |
| 관계식 | G = H - TS (H는 엔탈피, T는 절대 온도, S는 엔트로피) dG = VdP - SdT (V는 부피, P는 압력) |
| 기호 | ΔG° |
|---|---|
| 정의 | 표준 상태에서 반응물에서 생성물로 전환될 때의 깁스 자유 에너지 변화 |
| 공식 | ΔG° = ΔH° - TΔS° (ΔH°는 표준 엔탈피 변화, ΔS°는 표준 엔트로피 변화) |
| 관련 개념 | 헬름홀츠 자유 에너지, 엔탈피, 엔트로피, 열역학 퍼텐셜 |
|---|
-
상태 함수 -
엑서지
엑서지는 계와 환경의 상호작용에서 얻을 수 있는 최대 유효 일로, 열역학 제2법칙과 관련되어 에너지의 질을 측정하는 척도로 사용되며, 시스템 효율성 평가 및 지속 가능한 발전 전략 수립에 활용된다. -
상태 함수 -
온도
온도는 물체의 뜨겁고 차가운 정도를 나타내는 물리량으로, 열역학적으로는 에너지 이동 방향으로 정의되며, 미시적으로는 분자 운동 에너지의 평균값으로 정의되고, 화학 반응 속도와 생명체에 큰 영향을 미친다. -
물리학 개념 -
절연체
절연체는 전기 전도성을 막아 전기의 흐름을 제어하고 안전을 확보하며, 밴드 이론에 따라 큰 띠틈을 가져 외부 전압이 띠틈을 넘어서면 절연 파괴가 발생하며, 유리에서 세라믹, 고분자 복합 재료 등으로 제작되어 전선, 케이블 등 다양한 분야에 사용된다. -
물리학 개념 -
전기 전도체
-
물리학에 관한 -
전력
전력은 전압과 전류의 곱으로 계산되며, 발전소에서 생산되어 송전 및 배전을 통해 소비자에게 공급되고, 에너지 저장 기술을 통해 안정적으로 공급될 수 있으며, 산업, 상업, 가정 등 다양한 분야에서 소비된다. -
물리학에 관한 -
N형 반도체
2. 역사와 명칭
조사이어 기브스가 깁스 자유 에너지를 도입하였다고 알려져 있으나, 실제로는 20세기 초 서양에서 효율적인 공정 시스템을 위한 필요에 의해 기술자 5명이 모여 이 식을 만들었다. 이 식은 대량생산을 위해 거시적인 관점에서 해석된다. 흔히 물리학에서는 "깁스 자유 에너지" 또는 "자유 엔탈피"로 불리나, IUPAC는 "깁스 에너지"라는 용어를 권장한다.
“자유 에너지”라는 용어는 물리화학 초기 화학자들이 화학 반응을 일으키는 ‘힘’을 설명하기 위해 사용했던 구식 용어인 ‘친화도’를 대체하는 더욱 발전되고 정확한 용어이다. 1873년, 조시아 윌러드 깁스는 "표면을 이용한 물질의 열역학적 성질의 기하학적 표현 방법"이라는 논문에서 여러 물체나 계가 접촉했을 때 다양한 자연 과정이 일어나는 경향을 예측하거나 추정할 수 있는 새로운 방정식의 원리를 제시했다. 깁스는 고체, 액체, 기체로 이루어진 물체의 상호 작용을 연구하고, 3차원 부피-엔트로피-내부 에너지 그래프를 사용하여 평형 상태와 변화 가능성을 결정했다. 깁스는 일정한 압력 p와 온도 T의 매질에 둘러싸인 물질에 대한 열역학적 평형의 필요충분조건을 방정식 δ(ε − Tη + pν) = 0 으로 표현했다. 여기서 ε는 물체의 내부 에너지, η는 물체의 엔트로피, ν는 물체의 부피를 나타낸다.
1882년, 헤르만 폰 헬름홀츠는 친화도를 반응이 가역적으로 진행될 때 얻을 수 있는 최대 작업량으로 특징지었다. 따라서 최대 작업량은 계의 자유 에너지 감소로 간주되며 (T = 일정, P = 일정일 때 깁스 자유 에너지 G), 방출되는 열은 일반적으로 계의 총 에너지 감소의 척도이다. 따라서 G는 주어진 조건에서 작업에 “자유로운” 에너지량이다.
이후 60년 동안 친화도라는 용어는 자유 에너지라는 용어로 대체되었다. 길버트 N. 루이스와 머리 랜달이 1923년에 저술한 "열역학과 화학 물질의 자유 에너지"는 영어권 국가에서 "친화도"라는 용어를 "자유 에너지"라는 용어로 대체하는 데 기여했다.
3. 정의
깁스 자유 에너지는 어떤 계의 엔탈피, 엔트로피 및 절대 온도를 이용하여 정의하는 열역학적 함수이며, 다음과 같이 정의된다.
:
엔탈피 H를 사용하면 다음과 같이 표현할 수 있다.
:
여기서:
* U는 내부 에너지(국제 단위: 줄)
* p는 압력(국제 단위: 파스칼)
* V는 부피(국제 단위: m3)
* T는 절대 온도(국제 단위: 켈빈)
* S는 엔트로피(국제 단위: 줄 매 켈빈)
* H는 엔탈피(국제 단위: 줄)
표준 생성 에너지를 이용하면 다음과 같이 쓸 수 있다.
:
여기에서:
* G°는 표준 에너지(국제 단위: 줄)
* R 은 기체 상수(국제 단위: 줄 매 켈빈 몰)
* Q는 반응 지수
깁스 자유 에너지 값을 이용하면 일정한 온도와 압력이 유지된 상태에서의 화학 반응의 평형 조건을 알 수 있으며, 정반응이 자발적인지 비자발적인지 계산을 통해 알 수 있다.
깁스 자유 에너지는 외부 힘(예: 전기적 또는 자기적) Xi의 작용을 받는 개방계에 대해, 다음과 같이 표현할 수 있다.
:
여기서:
* μi는 i번째 화학종의 화학퍼텐셜이다. (SI 단위: 입자당 줄 또는 몰당 줄)
* Ni는 i번째 화학 성분을 구성하는 입자 수(또는 몰 수)이다.
이상 기체에 대한 깁스 에너지의 온도 의존성은 깁스-헬름홀츠 방정식에 의해 주어지며, 압력 의존성은 다음과 같이 주어진다.
:
또는 더 편리하게 화학 퍼텐셜로 표현하면:
:
비이상 시스템에서는 퓨가시티가 작용한다.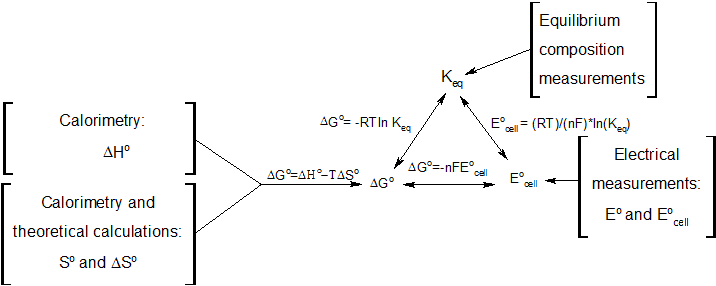
4. 전개
깁스 자유 에너지의 전미분은 자연 변수에 대해 르장드르 변환을 통해 내부 에너지로부터 유도될 수 있다.
:
위에서 정의한 G는 다음과 같다.
:.
전미분을 취하면 다음을 얻는다.
:
제1 법칙의 결과를 사용하여 dU를 대체하면
:
따라서 G의 자연 변수는 p, T, 그리고 {Ni}이다.
4.1. 깁스 자유 에너지와 자발성
일정한 온도와 압력에 놓인 계에서 깁스 자유 에너지 변화량(ΔG)은 계와 주위의 전체 엔트로피 변화에 비례한다. 즉 ΔG=ΔH-TΔS이다.
* ΔG > 0 이면 정반응이 비자발적인 반응으로 역반응이 자발적인 반응이 된다.
* ΔG = 0 의 경우 ΔS_계=ΔH_계/T 가 돼서 정반응과 역반응이 평형인 상태가 된다.
* ΔG < 0 인 경우에는 정반응이 자발적인 반응이 된다.
S, V, Ni가 넓이 변수이기 때문에, 오일러 관계를 이용하여 dU를 쉽게 적분할 수 있다.
:
G의 자연 변수 중 일부는 세기 변수이므로, 내부 에너지의 경우와 같이 오일러 관계를 사용하여 dG를 적분할 수는 없다. 그러나 U에 대한 위의 적분 결과를 G의 정의에 대입하면 G에 대한 표준 표현식을 얻을 수 있다.
:
이 결과는 물질 의 화학 퍼텐셜이 부분 몰(분자) 깁스 자유 에너지임을 보여준다. 이것은 균질한 거시적 시스템에는 적용되지만 모든 열역학적 시스템에는 적용되지 않는다.
4.2. 깁스 자유 에너지 유도
일정한 압력과 온도에서 화학 반응이 진행되는 동안, 계의 에너지는 다음과 같이 나타낼 수 있다.
:
에너지는 들어온 열의 양과 주위로부터 받은 일의 양의 합으로 나타낼 수 있다. 여기에서 일 은 로 나타낼 수 있다. 즉,
:
이고, 여기서 열
:
가 된다. 이때 를 엔탈피의 변화량 로 나타낼 수 있다. 주위가 잃어버린 열은 계에 그대로 전달되기 때문에
:
가 된다.
:
를 이용하면
:
:
:
이다. 이 식을 변화시켜
:로 쓰면
계에 관한 식
:
이 된다.
깁스 자유 에너지의 전미분은 자연 변수에 대해 르장드르 변환을 통해 내부 에너지로부터 유도될 수 있다.
:
위에서 정의한 G는 다음과 같다.
: .
전미분을 취하면 다음을 얻는다.
:
제1 법칙의 결과를 사용하여 dU를 대체하면
:
따라서 G의 자연 변수는 p, T, 그리고 {Ni}이다.
4.3. 반응에서의 깁스 자유 에너지
열역학 제2법칙에 의해 ΔS>=0이다. 가역반응인 경우에만 등호가 성립된다. 계와 주위가 연결되어 있기 때문에 닫힌 계에서 주위가 잃은 엔트로피는 계가 얻는다.
:이다. 엔트로피에서 인 관계가 성립되므로
주위에서 엔트로피 변화는 다음과 같이 나타낼 수 있다.
:
열역학 제2법칙을 이용하면
:
양변에 온도를 곱해주면
이 된다. 여기에서 Q는 계로부터 이동된 열이기 때문에 등압 과정에서 Q = ΔH이고
:
이다.
깁스 자유 에너지 변화량은 다음과 같이 나타내어지므로,
:
주위의 엔트로피가 낮아지는 경우 즉, 계의 엔트로피가 높아지는 경우 이므로 정반응이 자발적인 반응이 되는 것이다.
하지만 다음 과정으로부터 구한 식
:
이 항상 사용될 수 있는 것은 아니다. 이 경우에 온도를 일정하다고 가정한 식이므로 온도가 변화할 경우에는 보정을 거친 식을 이용하여야 한다.
일정한 온도와 압력에서 유지되며 닫힌 계(물질의 출입이 없음)에서 깁스 에너지의 미소 변화는 열역학 제1법칙과 열역학 제2법칙에 따라 다음과 같이 나타낼 수 있다.
:
기계적 일만 행해진다고 가정하면, 이것은 다음과 같이 간소화된다.
:
이는 평형 상태에 있지 않은 이러한 계의 경우 깁스 에너지는 항상 감소하고, 평형 상태에서는 미소 변화 dG가 0이 됨을 의미한다. 특히, 이것은 계가 평형에 이르는 경로에서 여러 개의 내부 화학 반응을 겪는 경우에 해당한다.
4.4. 표준 깁스 자유 에너지
엔트로피와 엔탈피의 표준 반응값과 같이 깁스 자유 에너지도 표준 반응값을
:
으로 구할 수 있다.
엔트로피에서
:
이다. 는 나중상태의 배열 수이고, 는 처음상태의 배열 수이다. 배열수는 부피에 비례하고, 압력에 반비례하는 관계이기 때문에
: 가 성립한다.
:
따라서 로 바꿔 쓸 수 있다. 여기서 처음 압력 bar이다.
화학 반응식에 이를 대입하면
:
가 된다. 여기서 Q는 반응 지수로 평형 상수와 같은 형태를 띠며 기체의 경우 압력에 관한 식으로도 사용할 수 있다.
위의 식을 이용하여
: 식을
: 로 바꾸어 쓸 수 있다.
엔탈피는 온도에 영향을 받는 함수로 이 반응에서 온도변화가 없는 경우이므로
:
:
즉
:라는 식이 성립된다.
표준 깁스 자유 에너지 값은 일정한 온도인 298K에서의 값이기 때문에 298K이 아닌 온도에서 반응을 진행하면 깁스 자유 에너지 값이 변화된다.
이 때의 값을 위의 식을 이용하여 구할 수 있으며 두 값의 차이는 그리 크게 나지는 않는다.
표준 생성 기브스 자유 에너지는 25 °C 및 100 kPa에서 각 원소의 표준 상태(가장 안정적인 형태)의 구성 원소로부터 1 몰의 물질을 생성하는 데 수반되는 기브스 자유 에너지 변화이다. 기호는 ΔfG˚이다.
모든 원소는 그들의 표준 상태(이원자 산소 기체, 흑연 등)에서 표준 생성 기브스 자유 에너지 변화가 0과 같다. 왜냐하면 어떠한 변화도 포함되지 않기 때문이다.
: ΔfG = ΔfG˚ + RT ln Qf,
여기서 Qf는 반응 지수이다.
평형 상태에서 ΔfG = 0이고 Qf = K이므로 방정식은 다음과 같이 된다.
: ΔfG˚ = −RT ln K,
여기서 K는 표준 상태의 원소로부터 물질의 생성 반응의 평형 상수이다.
5. 전기화학에서의 깁스 자유 에너지
전기화학 전지의 전극 사이로 전하 dQele가 이동하고 기전력(Electromotive force, emf) 를 발생시키면, 깁스 에너지 변화 표현식에 전기적 일 항이 나타난다.
여기서 S는 엔트로피, V는 계의 부피, p는 압력, T는 절대온도이다.
(, Qele)는 공액 변수 쌍의 한 예이다. 일정 압력에서 위 방정식은 열린 전지 전압의 온도 T(측정 가능한 양) 변화를 전하가 등온 과정 및 등압 과정으로 이동할 때 엔트로피 S 변화와 연결하는 맥스웰 관계식을 생성한다. 이 맥스웰 관계식은 다음과 같다.
:
1몰의 이온이 용액에 들어가면, 외부 회로를 통한 전하는 다음과 같다.
:
여기서 n0은 이온당 전자 수이고, F0는 패러데이 상수이며, 마이너스 부호는 전지의 방전을 나타낸다. 일정한 압력과 부피를 가정하면, 전지의 열역학적 특성은 기전력의 거동과 다음과 같이 엄격하게 관련된다.
:
여기서 ΔH는 반응 엔탈피이다.
6. 네른스트 식 유도
일정한 온도와 압력에서 가역적인 전기화학 반응이 일어나는 동안, 다음과 같은 깁스 자유 에너지와 관련된 방정식이 성립한다.
: (화학 평형 참조)
: (화학 평형 상태의 계에 대해)
: (일정한 온도와 압력에서 가역적인 전기화학 과정에 대해)
: (의 정의)
위 식들을 정리하면 다음과 같다.
:
이 식은 반응으로 인한 전지 전위를 그 반응에 대한 평형 상수 및 반응 지수와 관련짓는다(네른스트 식).
여기서,
* ΔrG영어는 반응물 1몰당 깁스 자유 에너지 변화이다.
* ΔrG°영어는 표준 조건(298 K, 100 kPa, 각 반응물과 생성물 1 M)에서 혼합되지 않은 반응물과 생성물에 대한 반응물 1몰당 깁스 자유 에너지 변화이다.
* R은 기체 상수이다.
* T는 절대 온도이다.
* ln은 자연로그이다.
* Qr영어은 반응 지수(무차원)이다.
* Keq영어는 평형 상수(무차원)이다.
* welec,rev영어는 가역 과정에서의 전기적 일(화학적 기호 규칙)이다.
* n은 반응에서 전달되는 전자의 몰 수이다.
* F {{=}} NAe ≈ 96485 C/mol영어는 패러데이 상수(전자 1몰당 전하량)이다.
* 는 전지 전위이다.
* 는 표준 전지 전위이다.
또한, 다음과 같은 관계가 성립한다.
:
이는 평형 상수를 깁스 자유 에너지와 관련짓는다. 평형 상태에서는
: 이고 이다.
7. 표준 생성 깁스 자유 에너지
표준 생성 기브스 자유 에너지는 25 °C 및 100 kPa에서 각 원소의 표준 상태(가장 안정적인 형태)의 구성 원소로부터 1 몰의 물질을 생성하는 데 수반되는 기브스 자유 에너지 변화이다. 기호는 ΔfG˚이다.
모든 원소는 그들의 표준 상태(이원자 산소 기체, 흑연 등)에서 표준 생성 기브스 자유 에너지 변화가 0과 같다. 왜냐하면 어떠한 변화도 포함되지 않기 때문이다.
: ΔfG = ΔfG˚ + RT ln Qf,
여기서 Qf는 반응 지수이다.
평형 상태에서 ΔfG = 0이고 Qf = K이므로 방정식은 다음과 같이 된다.
: ΔfG˚ = −RT ln K,
여기서 K는 표준 상태의 원소로부터 물질의 생성 반응의 평형 상수이다.

